- Startseite Mikrochemie
- Geschichte und Forscher
- Nichtquant. Techniken
- Quantitative Techniken
- Mikrochemie des Metallurgical Project (Manh.Proj)
- Die Mikrowaagen des "Metallurgical Project"
- Anwendungsbeispiele der Mikrochemie
- Mikro-Gravimetrie von Silber (NEU)
- Mikrodichtebestimmung
- Ultramikro-Nachweise auf "condenser rod"
- Der Aufschluss in der Mikrochemie (NEU)
- Mikro-Iodometrie von Cobalt in Gemischen
- -unbekanntes Mineral
- -Erfassungsgrenze für Fe (III)
- -Neusilber-Analyse
- -Mixit-Analyse
- -Mikrocolorimetrie
- -Hg-Nachweis in Zinnober
- -Goldnachweis in Coloradorit
- -Untersuchung von Kolwezit
- Mikrochemische Komplexometrie (Bi neben Pb)
- Mikrochem. Unters. an einem Mineral
- Ungewöhnliche Kristalle (NEU)
Aufschlüsse in der Mikrochemie
Auch die Technik des Aufschlusses läßt sich bis zu einem gewissen Grade den oft sehr geringen Substanzmengen, die für die Mikrochemie zur Verfügung stehen, anpassen.
Das folgende Bild zeigt eine Anordnung, die für Substanzmengen im einstelligen Milligram-Bereich und darunter geeignet ist.
Ein Physiker aus dem "Mikroskopie-Forum" hat es für den Autor erdacht und gebaut.
Es besteht aus einer Spirale aus Kanthaldraht, die mit Hochtemperatur-Zement umhüllt ist und von einem leistungsstarken Labornetzteil (20A) "befeuert" wird.
Diese Anordnung erreicht Temperaturen von über 1000°C, was für die meisten Aufschlüsse gut reicht.
Unter dem "Reaktor" wurde eine vergoldete Hitzeschutz-Platte angebracht, die aber, wie man sieht, in Mitleidenschaft gezogen wird.
Auf den Boden der Spirale läßt sich ein kleines Schälchen aus Platin (o.ä.) setzen, in dem der Aufschluss stattfindet. (hier 5 mm)


Ein geologisch tätiger Freund bat um die Bestätigung für das Mineral Koppit, daß er in sehr geringer Menge innerhalb eines anderen Minerals gefunden hatte.
Koppit ist ein komplexes Niob-haltiges Mineral der Formel A2Nb2(O,OH)6 mit A = Na, Ca, Sn, Sr, Pb, Sb u.v.m.[4] und wird an den verschiedensten Orten der Welt gefunden, so z.B. auch am Kaiserstuhl in Deutschland. Es läßt sich, außer in Flusssäure, in keiner anderen Säure auflösen, und muss zu diesem Zwecke also einem Aufschluss mit Pottasche zum Opfer fallen. Wenn man nur wenige Milligramm des Minerals zur Verfügung hat, muss dieser Aufschluss darüberhinaus notwendigerweise mit den Methoden der Mikrochemie durchgeführt werden.


Die wenigen, winzigen, vermuteten Koppit-Kristalle wurden unter einem Stereomikroskop ausgesondert und mit etwa der 10-fachen Menge Kaliumkarbonat möglichst schnell im kleinen Achatmörser zerkleinert und vermengt.
Das Gemisch wird dann auf den kleinen Platin-Tiegel verbracht und vorsichtig in den "Reaktor" gestellt.



Der "Reaktor" in nahezu Weissglut.
Wenn die Schmelze nicht mehr brodelt, kann nach weiteren 10 Minuten abgekühlt werden.
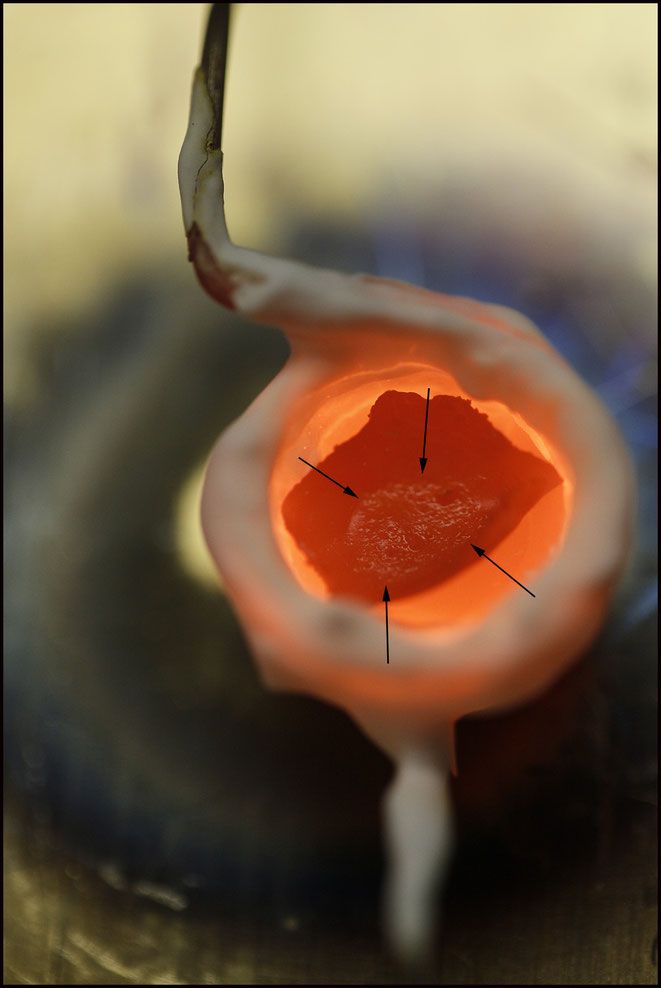

Das Resultat im Tiegel, der nun in toto in einer möglichst geringen Menge verdünnter Kalilauge bei etwa 40 °C digeriert wird. 3 µl dieser Lösung werden auf einen Objektträger gebracht und ein oder zwei kleine NaCl-Kristalle vom Rand her "eingeschoben".
Nach kurzer Zeit bilden sich in großer Zahl die typischen Kristalle des Natriumniobats (Na8[Nb2O3(NbO4)4] ∗ 16 H2O)[1], das im Gegensatz zum Kaliumniobat in verdünnter Kalilauge schwer löslich ist.
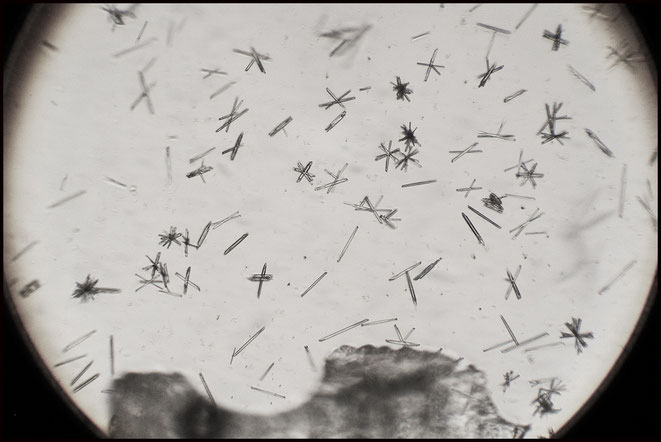
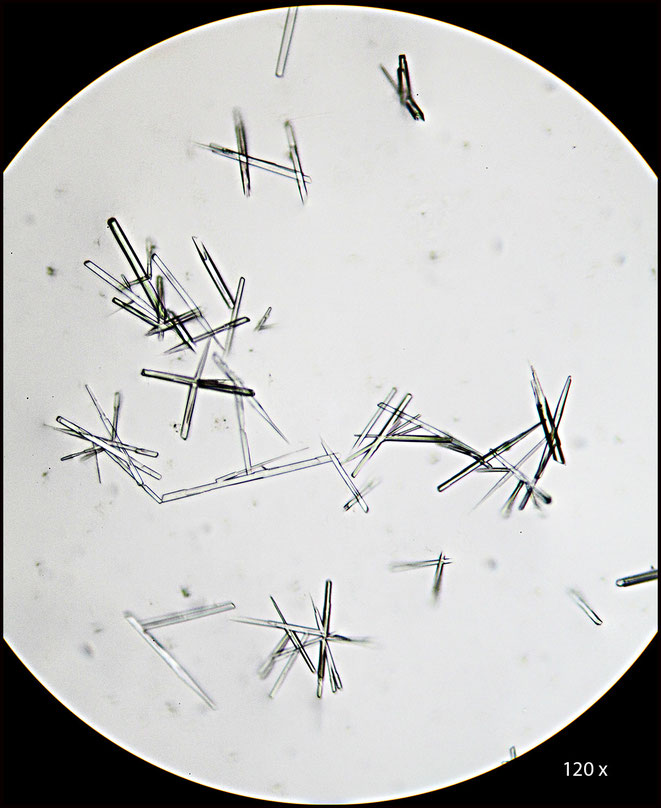
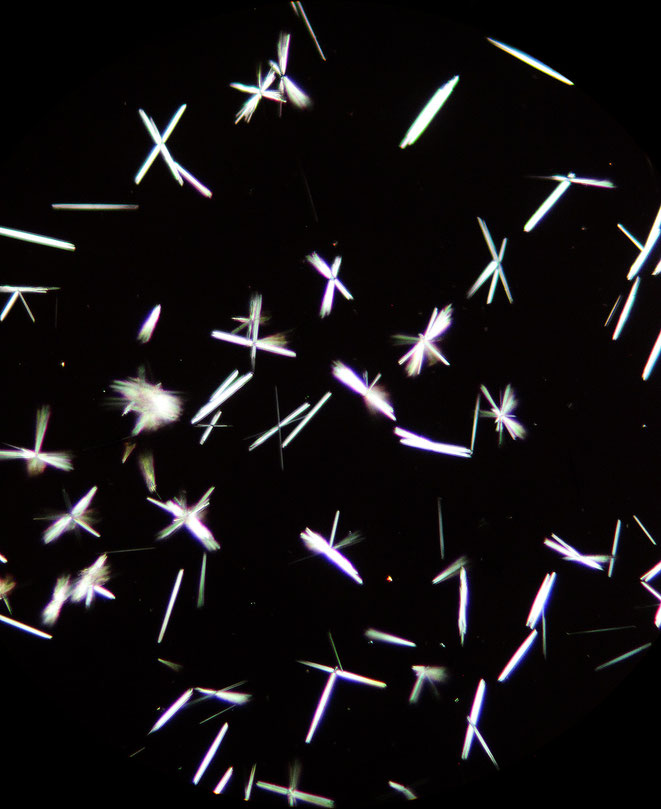
Die Kristallform entspricht den Bildern in der Literatur [1],[2] und beweisen eine größere Menge Niob in den Kristallen. Eine Ähnlichkeit der Kristalle zu denen der entsprechenden Tantal-Verbindung ist gegeben. Nach meinem Wissen ist aber Tantal im Koppit des Kaiserstuhls nicht vorhanden.
Kritik:
Da die zum mikroskopischen Nachweis benutzten Kristalle der Natrium-Verbindung in Wasser kaum löslich sind, wäre der übliche Zusatz von Soda zum Aufschluß kontraproduktiv. Der Aufschluß wird also
nur mit Kaliumkarbonat durchgeführt. Der Schmelzpunkt des Aufschlusses beträgt dann etwa 850°C- 900°C, während der "Soda-Pottasche-Aufschluss" nur auf eine Temperatur von 720°C gebracht werden
muss.
Im Aufschluss mit Kaliumkarbonat sollen wohl Salze der Zusammensetzung 4K2O * 3 Nb2 O5 * 16 H2O[1] entstehen, die in Wasser und Kalilauge
löslich sind, während die entsprechenden Natrium-Salze schwer löslich sind und charakteristische Nachweiskristalle bilden, wobei diese aber von den Tantal-Salzen nicht differenzierbar sind.
Literatur:
[1]Fresenius, Handbuch der Analytischen Chemie, Elemente Der Vierten Nebengruppe und Der Fünften Gruppe
[2]Geilmann, Bilder Zur Qualitativen Mikroanalyse Anorganischer Stoffe; 1954
[3]https://vfmg.de/2019/08/gewichtige-zwil ...
nd-tantal/
[4]https://www.mineralienatlas.de/lexikon/ ... ral=Koppit
