- Startseite Mikrochemie
- Geschichte und Forscher
- Nichtquant. Techniken
- Quantitative Techniken
- Mikrochemie des Metallurgical Project (Manh.Proj)
- Die Mikrowaagen des "Metallurgical Project"
- Anwendungsbeispiele der Mikrochemie
- Mikro-Gravimetrie von Silber (NEU)
- Mikrodichtebestimmung
- Ultramikro-Nachweise auf "condenser rod"
- Mikro-Iodometrie von Cobalt in Gemischen
- -unbekanntes Mineral
- -Erfassungsgrenze für Fe (III)
- -Neusilber-Analyse
- -Mixit-Analyse
- -Mikrocolorimetrie
- -Hg-Nachweis in Zinnober
- -Goldnachweis in Coloradorit
- -Untersuchung von Kolwezit
- Mikrochemische Komplexometrie (Bi neben Pb)
- Mikrochem. Unters. an einem Mineral
- Ungewöhnliche Kristalle (NEU)
Eine neuartige Sorte von Kristallen
Im Laufe meiner mikrochemischen Arbeiten mit Tripelnitriten bin ich vor einigen Jahren durch Zufall auf eine ungewöhnliche Kristallkonfiguration gestoßen, die ich nun hier vorstellen möchte,
Nach Aussagen einiger Fachleute und einer intensiven Recherche der Literatur sind m.E. diese Kristalle bisher nicht beschrieben worden.
Ich möchte sie unter dem Namen "Schachtelkristalle" vorstellen.
Tripelnitrite gehorchen der allgemeinen Summenformel:
(K,Rb,Cs,Tl)2 (Pb,Sr,Ba,Cd) (Cu,Ni) (NO2)6
Das heißt: typische Vertreter der Kristallklasse wären z.B.:
Cs2BaNi(NO2)6
oder:
K2CdCu(NO2)6
Das wohl allen anorganisch tätigen bekannteste Tripelnitrit ist:
K2PbCu(NO2)6,
der je nach Konzentration der Teilnehmer typische, gelbbraune bis schwarze kubische Nachweiskristall sowohl für Blei, wie auch für Kupfer.
(Bild folgt)
Während die kubische Form der Tripelnitrite bei den einzelnen Vertretern gleich ist, unterscheiden sie sich deutlich bezüglich Farbe, Größe und Löslichkeit.
Eine tiefe Schwärze sowie eine erhebliche Größe kann nur bei der Metallkombination Cu/Pb erzielt werden, während eine Überzahl von Metall-Kombinationen aus kleineren bis kleinen gelben Kristallen besteht.
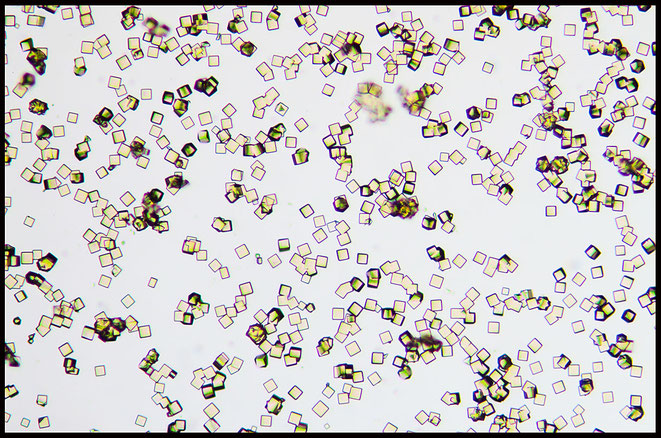
K2SrNi(NO2)6
Eine interessante farbliche Ausnahme ist die Kombinationen aus den Metallen Strontium und Kupfer, die zu großen gras- bis tiefgrünen Kristallen führt.

K2SrCu(NO2)6
Mein Gedanke war nun, ob es wohl gelingen könnte, in einer geeigneten Lösung von Kupfer und Nickel, durch Zusatz von Strontium-Ionen eine Darstellung der beiden Einzelkristalle, sozusagen "in friedlicher Koexistenz" zu erzielen und damit die Elemente Kupfer und Nickel gleichzeitig unter dem Mikroskop nachzuweisen. Mein besonderes Interesse war damals auf das Mineral "Gillardit" gerichtet, das beide Metalle enthält.
Erste Versuche, eine Trennung durch Zusatz von Blei-Ionen zu erreichen misslang, da sich ein brauner Mischkristall bildete, der natürlich zur weiteren Differenzierung unbrauchbar war.
Dann kam mir die Idee, statt des Bleis das Strontium-Ion zu verwenden und zu meiner Überraschung zeigte sich im Randbereich des Gemischtropfens auf dem Objektträger folgendes Bild:
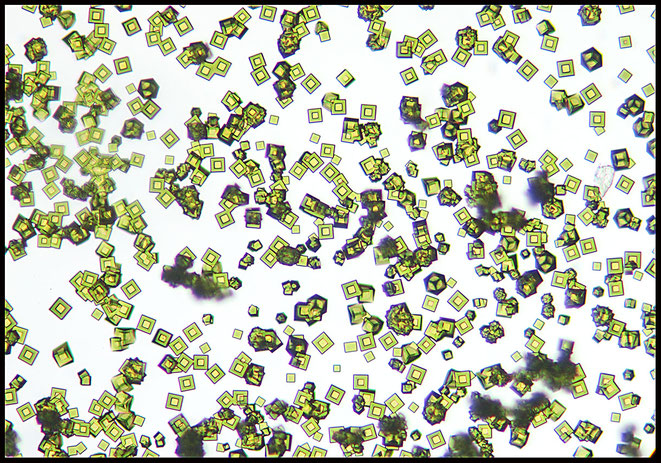
Neben "unverbrauchten" grünen Sr/Cu- und Sr/Ni-Kristallen zeigen sich zahlreiche "geschachtelte" Kristalle mit einem Kern aus gelbem Sr/Ni-Tripelnitrit und einer Hülle ausgrünem Sr/Cu-Tripelnitrit und das in sehr scharfer und symmetrischer Anordnung.
Also keine "friedliche Koexistenz" und auch keine Mischkristalle.

Vereinzelt kommt es zu Verwachsungen.


Durch gezielte Veränderungen der Konzentrationen der teilnehmenden Ionen entstehen unterschiedliche Morphologien.

In diesem Foto sieht man im Zentrum die Ansicht der Kristalle von einer Ecke her; im Randbereich und im Foto unten sieht man eine Dreifachschichtung mit gleichzeitiger Verwachsung!

Leichter bilden sich diese Kristalle, wenn das Kupfer erst zugegeben wird, nachdem sich bereits möglichst große, gelbe Sr/Ni-Kristalle auf dem Objektträger gebildet haben und wenn man direkt mit den Citraten aller Teilnehmer arbeitet.
Wenn man in diesem Sinne wieder zunächst die Sr/Ni-Kristalle "vorzüchtet" und dann statt Cu Blei-Ionen zugibt, ensteht die nächste Überraschung:


"Wilde" Mehrfach-Schichtungen bis zu 4-fach!

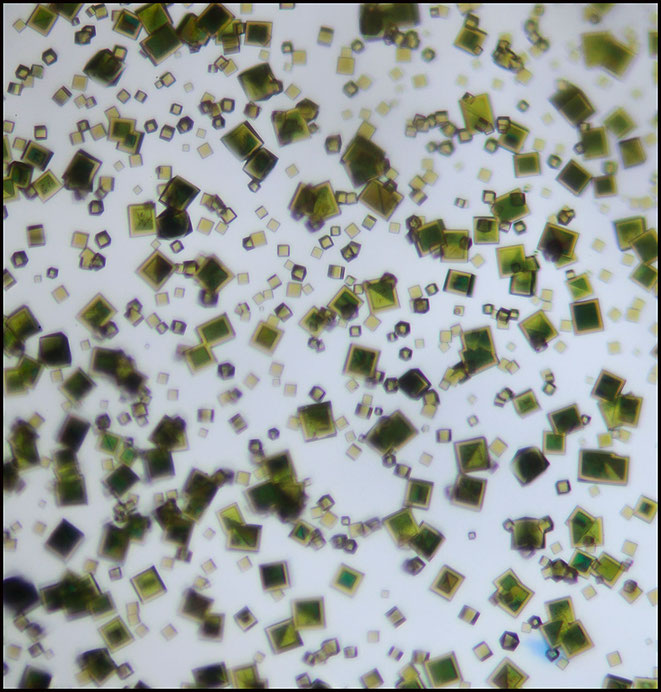
Der Versuch, nun die grünen Sr/Cu-Tripelnitrite vorzulegen und dann die gelben Sr/Ni-Kobination "überzustülpen", ergibt dieses Bild. Eine scharfe Grenze zwischen den Teilnehmern zu erzielen, gelingt nur schwer.
Im weiteren konnte ich feststellen, daß die grünen Sr/Cu-Kristalle anisotrop sind, d.h. im polarisierten Licht des Mikroskops hell aufleuchten, während die gelben Kristalle isotrop sind.
Daraus ergeben sich für die "Schachtelkristalle" die folgenden interessanten Bilder:
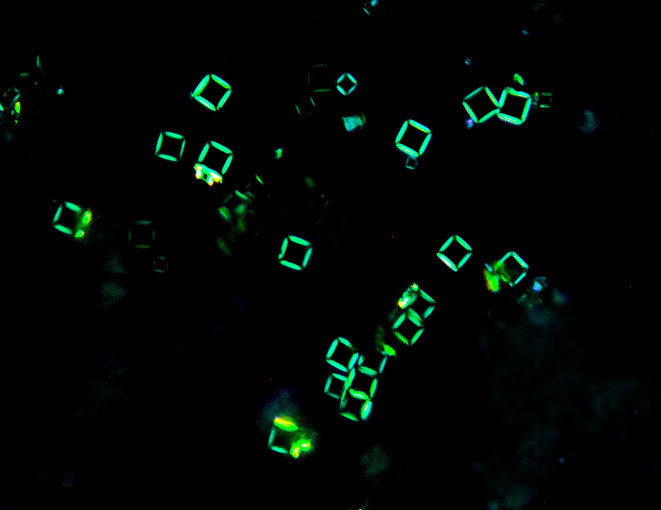

Hellgrün aufleuchtend im Randbereich die Sr/Cu-Hülle, im Zentrum die isotrope gelbe Sr/Ni-Verbindung.

Weniger interessant die Polarisationsaufnahme der umgekehrten Schachtelung.
Die Herstellung dieser Schachtelkristalle erfordert einige Übung, da die Konzentrationsverhältnisse in einem Tropfen auf dem Objektträger kaum reproduzierbar sind. Es empfiehlt sich, die Konzentrationen eher niedrig zu halten, da sonst große Mengen nicht umgesetzter Kristalle das Bild überlagern. Die Kristalle entstehen oft im Randbereich das Tropfens, wo sich durch Verdunstung irgendwann die richtige Konzentration ergibt.
Die starke Konzentrationsabhängigkeit zeigt sich in diesem Bild, wo erst im Bereich höherer Cu-Konzentration die gesuchten Schichtungen entstehen.

Hier ein "Kochrezept" für Interessierte:
(wie oben angemerkt, ist einiges Probieren unerläßlich!)
Auf einem Objektträger (OT) wurden gemischt:
3 µl H2O
0,3 µl 0,1 n Nickelacetat-Lösung
1 µl 0,1 n Strontiumacetat-Lösung
1 µl konz. Kaliumnitrit-Lösung
(möglichst wenig bewegen, damit schnell möglichst große Sr/Ni-Kristalle wachsen können!)
Nach kurzer Zeit bilden sich die gelben TN: K2SrNi(NO2)6
die man 1 - 2 Minuten wachsen läßt. Dann Zugabe von
0,5 µl 0,1 n Kupferacetat-Lösung; einmal kurz mit einer Glasspitze umrühren.
Obj.Träger 3 - 4 Minuten still liegen lassen!
Im Randbereich bilden sich zügig die größeren Schichtkristalle K2Sr(Ni,Cu)(NO2)6
Der Tropfen trocknet zunehmend aus und die Ausbeute erhöht sich.
Kein Deckglas benutzen.
Auszug aus einer Email von Professor Dr. Ulli E., Inst. für Anorgan. Chemie der RWTH Aachen:
vielen Dank für die wirklich faszinierenden Aufnahmen.
......
Ich habe noch nie einen Fall wie den Ihren gesehen; allerdings bin ich kein Experte in kristallmikrochemischen Nachweisen. Es ist beeindruckend, wie sauber die gelben Ni-haltigen von den grünen
Cu-haltigen Domänen getrennt sind.
....
Kommentare gerne an "uppuclub@gmx.de"
